風しんを正しく診断するには?―検査・研究から明らかになったこと―
掲載日:2023年4月24日
はじめに
当所では、風しんと麻しんの発生動向の正確な把握と分析を目的として、原則的に全ての風しんと麻しんの疑い症例についてウイルス核酸検査を実施しています。これら疑い症例から得られた検体や付随情報を用いた検査・研究から、風しん検査の必要性を示す知見や適切な検査の実施に貢献できる知見を得ましたので紹介させていただきます。
臨床症状での発しん性疾患の鑑別は難しい?
風しんや麻しんの迅速かつ正確な診断は、感染拡大の防止に不可欠です。私たちは、2011年から2021年までに大阪府内の医療機関で風しん又は麻しんが疑われた1356症例のウイルス核酸検査を実施しました。その中で、風しんウイルス、麻しんウイルスが検出されたのは、それぞれ166症例(12.2%)、167症例(12.3%)で、残りの1023症例(75.4%)の病原因子は不明でした。風しんと麻しんが否定された症例の病原因子を探索する目的で、伝染性紅斑の原因ウイルスであるパルボウイルスB19を対象としたウイルス核酸検査を実施しました(1)。その結果、検査が実施できた970症例中136症例(14.0%)でパルボウイルスB19が検出されました。これらの結果は、臨床症状のみで風しん、麻しん(修飾麻しん)、伝染性紅斑などの似た症状を示す発しん性疾患を鑑別することの難しさ、正確な診断には検査に基づく鑑別が必要であることを示しています。
風しんを正しく検査するには?
ウイルス検査はどのように行うのでしょうか。ウイルス検査法は、ウイルスに特異的な免疫グロブリン(Ig)M抗体の検出などの血清学的診断法と、ウイルス核酸の検出や感染性ウイルスの分離などの病原体検出法に分けられます。それぞれの検査法には、検査に適した発症からの時期があり、その時期を逃してしまうと適切な検査結果が得られない場合があります。過去に風しんと確定された症例の検体を用いて(2, 3)、私たちが明らかにしたことを紹介させていただきます。
まず、風しんウイルス特異的IgM抗体(以下、IgM抗体)検査に適した時期についてです。私たちは、ウイルス核酸検査で風しんと確定された症例について、発しん出現後の日数毎にIgM抗体の陽性率を解析しました(4, 5)。IgM抗体の陽性率は、発しん出現後0~2日目では40%未満と低く、3日目で61.5%、4日目で73.3%、5日目以降で80.0%でした。この結果から、風しん患者であっても、発しん出現直後にはIgM抗体が検出できない可能性が高いことがわかりました。
次に、ウイルス核酸検査とウイルス分離に適した時期についてです。私たちは、発しん出現後の日数毎にウイルス核酸濃度とウイルス分離の可否を評価しました(図)(6, 7)。ウイルス核酸濃度とウイルス分離率は、発しん出現後0~2日でピークに達し、時間経過とともに減少しました。発しん出現後、検体1mL当たりのウイルス核酸濃度の中央値は、血しょう/血清で3日目、末梢血単核球(PBMCs)で2日目、咽頭ぬぐい液で10~13日目、尿で6~7日目に検出下限値以下になりました。ウイルス核酸検査を実施する場合、発しん出現後早期に検体を採取する必要があることが明らかになりました。また、ウイルス分離は、発しん出現後、血しょう/血清で2日目まで、PBMCsで1日目まで、咽頭ぬぐい液で8~9日目まで、尿で4~5日目まで可能でした。発しん出現からの日数が短いほど感染性ウイルスを排出している可能性が高いことから、発しん出現後迅速に風しん患者を発見して感染伝播を防ぐ必要があります。ウイルス分離は時間がかかり迅速な検出には適しませんので、ウイルス核酸検査で発しん出現直後に風しん患者を発見することが重要ですが、発症後すぐに検体を採取できなかった場合はIgM抗体検査の併用が望ましいです。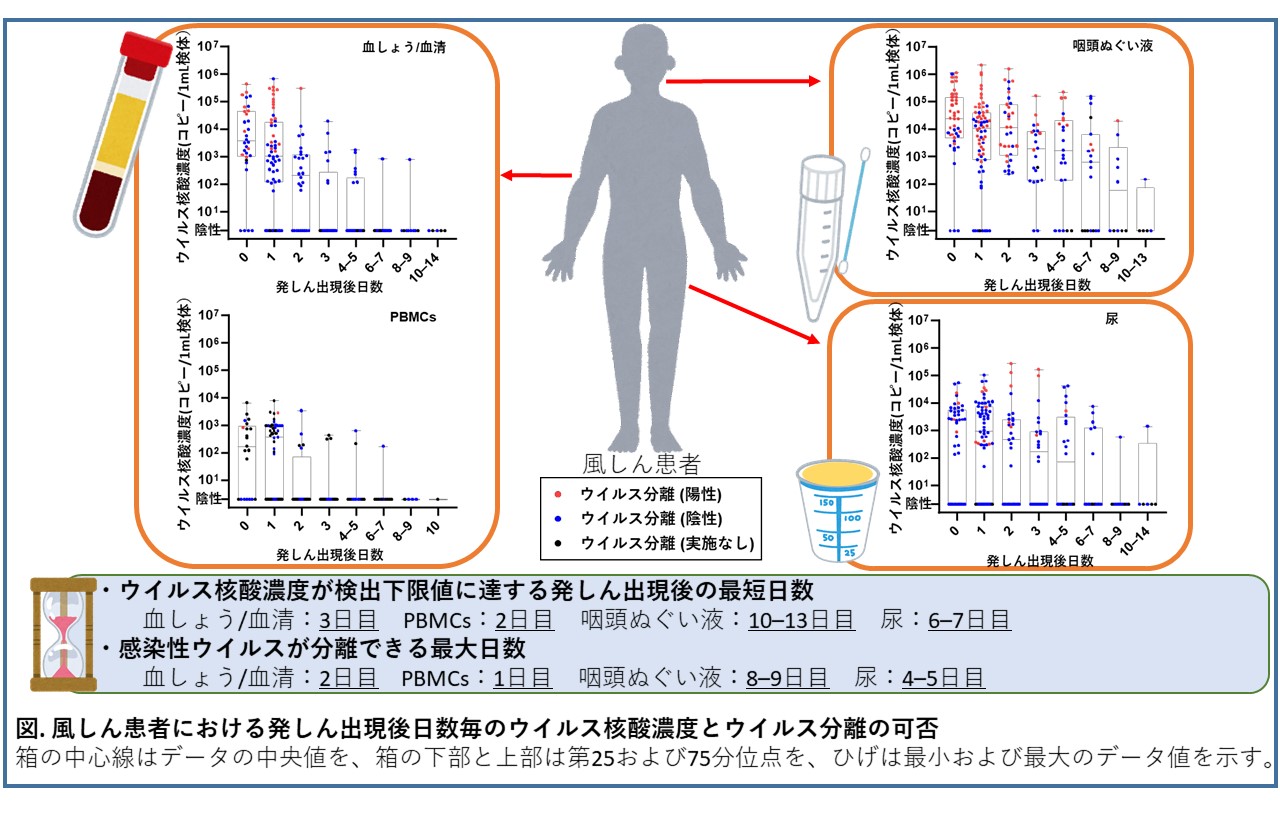
おわりに
今回明らかにした知見が、適切な検体採取や検査結果の解釈に貢献し、最終的に風しんの感染拡大の防止と国内からの排除に寄与できればと考えています。今後も、検査や研究を通して風しんなどの発しん性疾患の正確な発生動向の把握と有益な情報の発信に努めて行きたいと思います。
今回紹介させていただきました知見の詳細をお知りになりたい場合は、下記の参考文献をご参照ください。
(本研究の一部は、JSPS科研費JP17K09223、JP18K17367、JP18KK0271、JP21K10432の助成を受けたものです。)
参考文献
- Kaida Y, Kanbayashi D, Kurata T, Mori H. Contribution of Parvovirus B19 in Suspected Cases of Measles/Rubella in Osaka, Japan, between 2011 and 2021. Journal of Medical Virology, 95(3), e28593 (2023).
- Kanbayashi D, Kurata T, Nishino Y, Orii F, Takii Y, Kinoshita M, Ohara T, Motomura K, Yumisashi T. Rubella Virus Genotype 1E in Travelers Returning to Japan from Indonesia, 2017. Emerging Infectious Diseases, 24(9),1763–1765 (2018).
- Kanbayashi D, Kurata T, Kubo H, Kaida A, Yamamoto SP, Egawa K, Hirai Y, Okada K, Ikemori R, Yumisashi T, Yamamoto A, Yoshida H, Hirayama T, Ikuta K, Motomura K. Ongoing rubella epidemic in Osaka, Japan, in 2018– Western Pacific Surveillance and Response Journal, 11(2), 48–50 (2020).
- Kurata T, Uchino K, Hotta C, Ogura A, Miyoshi T, Ogawa T, Kanbayashi D, Tanaka T, Yumisashi T, Komano J. Clinical value of enzyme immunoassay that detects rubella-specific immunoglobulin M immediately after disease onset. Microbiology and Immunology, 63(1), 32–35 (2019).
- 成人における風疹IgM抗体価の診断的価値について, 病原微生物検出情報, 39, 37–38 (2018).
- Kanbayashi D, Kurata T, Kaida A, Kubo H, Yamamoto SP, Egawa K, Hirai Y, Okada K, Kaida Y, Ikemori R, Yumisashi T, Ito A, Saito T, Yamaji Y, Nishino Y, Omori R, Mori H, Motomura K, Ikuta K. Shedding of rubella virus in postsymptomatic individuals; viral RNA load is a potential indicator to estimate candidate patients excreting infectious rubella virus. Journal of Clinical Virology, 160, 105377 (2023).
- 風疹患者におけるウイルスRNAと感染性ウイルスの排出について, 病原微生物検出情報, 44, 51–53 (2023).
お問い合わせ
電話番号:06-6972-1402
